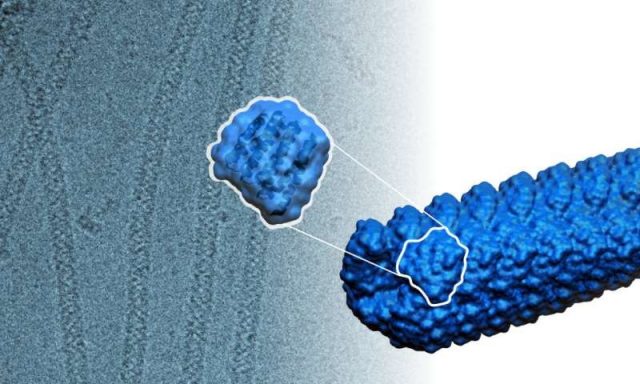
Για πρώτη φορά, οι επιστήμονες δημιούργησαν, από την αρχή, αυτοσυνθετικά νημάτια πρωτεϊνών, τα οποία κατασκευάστηκαν από όμοιες πρωτεϊνικές υπομονάδες που συγκλίνουν αυθόρμητα για να σχηματίσουν μακρές, ελικοειδείς, δομικές μορφές.
Στον φυσικό κόσμο, τα νημάτια πρωτεϊνών είναι απαραίτητα συστατικά διαφόρων δομικών και κινούμενων μερών στα ζωντανά κύτταρα, καθώς και σε πολλούς ιστούς του σώματος. Αυτές περιλαμβάνουν τους κυτταρικούς σκελετούς που δίνουν στα κύτταρα το σχήμα τους, τους κυτταρικούς μικροσωληνίσκους που ενορχηστρώνουν την κυτταρική διαίρεση, και η πιο κοινή πρωτεΐνη στο σώμα, το κολλαγόνο, η οποία δίνει τη δύναμη και την ευελιξία στο χόνδρο μας, το δέρμα και άλλους ιστούς.
“Το να είσαι σε θέση να δημιουργήσεις νήματα πρωτεΐνης από το μηδέν θα μας βοηθήσει να κατανοήσουμε καλύτερα τη δομή και τους μηχανισμούς των φυσικών ινών πρωτεΐνης και θα μας επιτρέψει να δημιουργήσουμε εντελώς νέα υλικά”, δήλωσε ο David Baker, καθηγητής της βιοχημείας στην Ιατρική Σχολή του Πανεπιστημίου της Ουάσινγκτον και διευθυντής του Ινστιτούτου Προστασίας της Πρωτεΐνης του UW, ο οποίος διευθύνει το έργο. Είναι επίσης ερευνητής του Ιατρικού Ινστιτούτου Howard Hughes.
Τέτοια υλικά μπορεί να περιλαμβάνουν τεχνητές ίνες που ισούνται ή ξεπερνούν την αντοχή του μεταξιού αράχνης, το οποίο κατά βάρος είναι ισχυρότερο από το χάλυβα, δήλωσε ο Baker, και ανέφερε επίσης την πιθανότητα κυκλωμάτων καλωδίου νανοκλίμακας.
Για να σχεδιάσουν τα νημάτια, οι ερευνητές χρησιμοποίησαν ένα πρόγραμμα υπολογιστή που αναπτύχθηκε στο εργαστήριο Baker, που ονομάζεται Rosetta, το οποίο μπορεί να προβλέψει το σχήμα μιας πρωτεΐνης από την αλληλουχία αμινοξέων της.
Για να λειτουργούν σωστά, οι πρωτεΐνες πρέπει να διπλώνονται σε ένα ακριβές σχήμα. Αυτή η δίπλωση οδηγείται από τις ιδιότητες των μεμονωμένων αμινοξέων και από το πώς αλληλεπιδρούν μεταξύ τους στο περιβάλλον. Οι δυνάμεις της έλξης και της απώθησης οδηγούν την πρωτεΐνη να ξεκουραστεί σε ένα σχήμα που έχει το χαμηλότερο επίπεδο ενέργειας.
“Είχαμε τελικά τη δυνατότητα να σχεδιάσουμε πρωτεΐνες που θα μπορούσαν να ταιριάζουν μαζί όπως τα Legos”, δήλωσε ο Hao Shen, Ph.D. υποψήφιος στο UW Molecular Engineering & Sciences Institute. Ο ίδιος και ο Jorge Fallas, ενεργός εκπαιδευτικός στη βιοχημεία της Ιατρικής Σχολής του UW, είναι επικεφαλής συγγραφείς ενός εγγράφου που περιγράφει την προσέγγιση.
Το παρόν έγγραφο θα δημοσιευθεί ηλεκτρονικά από το περιοδικό Science.
Οι ερευνητές έδειξαν επίσης ότι, με τη συσσώρευση με τη συγκέντρωση της σχεδιαζόμενης πρωτεΐνης σε διάλυμα και με την προσθήκη κεφαλών που παρεμπόδιζαν την ικανότητα του σχεδίου να δεσμεύει, θα μπορούσαν να οδηγήσουν τα νήματα να αναπτυχθούν ή να αποσυναρμολογηθούν.
“Η δυνατότητα προγραμματισμού της δυναμικής του σχηματισμού νήματος θα μας δώσει πληροφορίες για το πως η συναρμολόγηση και αποσυναρμολόγηση των νημάτων ρυθμίζεται στη φύση”, δήλωσε ο Baker.
Επιμέλεια Κειμένου: Κατερίνα Καλτσά












![Καλλιμάρμαρο: Παραδόθηκε η Ολυμπιακή Φλόγα στο «Παρίσι 2024»-Βίντεο [369158] ΛΑΜΠΑΔΗΔΡΟΜΙΑ ΤΩΝ ΟΛΥΜΠΙΑΚΩΝ ΑΓΩΝΩΝ "ΠΑΡΙΣΙ 2024" / 11η ΗΜΕΡΑ (ΜΑΡΚΟΣ ΧΟΥΖΟΥΡΗΣ / EUROKINISSI)](https://ecozen.gr/wp-content/uploads/2024/04/olympiaki-floga-300x194.jpg)



![Καλλιμάρμαρο: Παραδόθηκε η Ολυμπιακή Φλόγα στο «Παρίσι 2024»-Βίντεο [369158] ΛΑΜΠΑΔΗΔΡΟΜΙΑ ΤΩΝ ΟΛΥΜΠΙΑΚΩΝ ΑΓΩΝΩΝ "ΠΑΡΙΣΙ 2024" / 11η ΗΜΕΡΑ (ΜΑΡΚΟΣ ΧΟΥΖΟΥΡΗΣ / EUROKINISSI)](https://ecozen.gr/wp-content/uploads/2024/04/olympiaki-floga-100x75.jpg)